Struktura atomowa i molekularna

Elementami budulcowymi materii są atomy, które łączą się, tworząc cząsteczki lub związki. Ważne jest, aby znać części atomu, czym są jony i izotopy oraz jak łączą się atomy.
Części atomu
Atomy składają się z trzech komponentów:
- protony - dodatni ładunek elektryczny
- neutrony - bez ładunku elektrycznego
- elektrony - ujemny ładunek elektryczny
Protony i neutrony tworzą jądro lub centrum każdego atomu. Elektrony krążą wokół jądra. Tak więc jądro każdego atomu ma ładunek dodatni netto, podczas gdy zewnętrzna część atomu ma ładunek ujemny netto. W reakcjach chemicznych atomy tracą, zyskują lub dzielą elektrony. Jądro nie bierze udziału w zwykłych reakcjach chemicznych, chociaż rozpad jądra i reakcje jądrowe mogą powodować zmiany w jądrze atomowym.
Atomy, jony i izotopy
Liczba protonów w atomie określa, który to element. Każdy element ma jedną lub dwie litery symbol
który służy do identyfikacji go we wzorach chemicznych i reakcjach. Symbolem helu jest On. Atom z dwoma protonami jest atomem helu niezależnie od tego, ile ma neutronów lub elektronów. Atom może mieć tę samą liczbę protonów, neutronów i elektronów lub liczba neutronów i / lub elektronów może różnić się od liczby protonów.Atomy, które niosą dodatni lub ujemny ładunek elektryczny netto, to jony. Na przykład, jeśli atom helu straci dwa elektrony, miałby ładunek netto +2, co zapisano by jako He2+.
Różnica liczby neutronów w atomie określa, który izotop tego elementu. Atomy mogą być zapisywane za pomocą symboli jądrowych w celu identyfikacji ich izotopu, gdzie liczba nukleonów (protonów i neutronów) jest wymieniony powyżej i po lewej stronie symbolu elementu, a liczba protonów jest wymieniona poniżej i po lewej stronie symbol. Na przykład trzy izotopy wodoru to:
11H 21H 31H.
Ponieważ wiesz, że liczba protonów nigdy się nie zmienia dla atomu pierwiastka, izotopy są częściej zapisywane przy użyciu symbolu elementu i liczby nukleonów. Na przykład, możesz napisać H-1, H-2 i H-3 dla trzech izotopów wodoru lub U-236 i U-238 dla dwóch wspólnych izotopów uranu.
Liczba atomowa i masa atomowa
The Liczba atomowa atomu identyfikuje jego pierwiastek i liczbę protonów. The masa atomowa to liczba protonów plus liczba neutronów w elemencie (ponieważ masa elektronów jest tak mała w porównaniu z masą protonów i neutronów, że w zasadzie się nie liczy). Ciężar atomowy nazywany jest czasem masą atomową lub liczbą mas atomowych. Liczba atomowa helu wynosi 2. Masa atomowa helu wynosi 4. Zauważ, że masa atomowa elementu na układzie okresowym nie jest liczbą całkowitą. Na przykład masa atomowa helu jest podawana jako 4,003 zamiast 4. Wynika to z faktu, że układ okresowy odzwierciedla naturalną obfitość izotopów pierwiastka. W obliczeniach chemicznych używasz masy atomowej podanej w układzie okresowym, zakładając, że próbka pierwiastka odzwierciedla naturalny zakres izotopów tego pierwiastka.
Molekuły
Atomy oddziałują ze sobą, często tworząc ze sobą wiązania chemiczne. Kiedy dwa lub więcej atomów łączy się ze sobą, tworzą one cząsteczkę. Cząsteczka może być prosta, na przykład H.2lub bardziej złożone, takie jak C.6H.12O6. Indeksy dolne wskazują liczbę każdego rodzaju atomu w cząsteczce. Pierwszy przykład opisuje cząsteczkę utworzoną przez dwa atomy wodoru. Drugi przykład opisuje cząsteczkę złożoną z 6 atomów węgla, 12 atomów wodoru i 6 atomów tlenu. Chociaż możesz pisać atomy w dowolnej kolejności, konwencja polega na tym, że najpierw napisz dodatnio naładowaną przeszłość cząsteczki, a następnie ujemnie naładowaną część cząsteczki. Tak więc chlorek sodu jest zapisywany NaCl, a nie ClNa.
Uwagi i przegląd układu okresowego
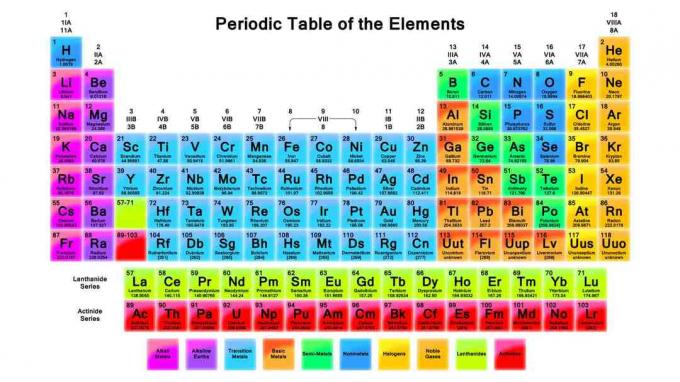
Układ okresowy jest ważnym narzędziem w chemii. Te uwagi zawierają przegląd układu okresowego, jego organizacji i trendów w układzie okresowym.
Wynalezienie i organizacja układu okresowego pierwiastków
W 1869 r. Dmitrij Mendelejew zorganizował pierwiastki chemiczne w układ okresowy podobny do tego, którego używamy dzisiaj, z wyjątkiem jego pierwiastków zostały uporządkowane według rosnącej masy atomowej, podczas gdy nowoczesny stół jest zorganizowany przez zwiększenie atomowej numer. Sposób organizacji pierwiastków umożliwia obserwowanie trendów we właściwościach pierwiastków i przewidywanie zachowania pierwiastków w reakcjach chemicznych.
Wywoływane są rzędy (od lewej do prawej) okresy. Elementy w okresie mają ten sam najwyższy poziom energii dla nie wzbudzonego elektronu. Istnieje więcej podpoziomów na poziom energii wraz ze wzrostem wielkości atomu, więc w kolejnych okresach jest więcej elementów.
Kolumny (od góry do dołu) stanowią podstawę elementu grupy. Elementy w grupach mają tę samą liczbę elektronów walencyjnych lub układ zewnętrznej powłoki elektronowej, co nadaje elementom w grupie kilka wspólnych właściwości. Przykładami grup pierwiastków są metale alkaliczne i gazy szlachetne.
Trendy okresowe lub okresowość
Organizacja układu okresowego pozwala na szybki przegląd trendów we właściwościach elementów. Ważne trendy dotyczą promienia atomowego, energii jonizacji, elektroujemności i powinowactwa elektronów.
-
Promień atomowy
Promień atomowy odzwierciedla rozmiar atomu. Promień atomowy zmniejsza ruch od lewej do prawej przez okres i zwiększa przejście z góry na dół w dół grupy elementów. Chociaż można by pomyśleć, że atomy po prostu staną się większe, gdy zdobędą więcej elektronów, elektrony pozostają w powłoce, podczas gdy rosnąca liczba protonów przyciąga powłoki bliżej jądra. Przechodząc w dół grupy, elektrony znajdują się dalej od jądra w nowych powłokach energetycznych, więc ogólny rozmiar atomu wzrasta. -
Energia jonizacji
Energia jonizacji to ilość energii potrzebnej do usunięcia elektronu z jonu lub atomu w stanie gazowym. Energia jonizacji zwiększa ruch od lewej do prawej przez okres i zmniejsza przejście od góry do dołu w dół grupy. -
Elektroujemność
Elektroujemność jest miarą tego, jak łatwo atom tworzy wiązanie chemiczne. Im wyższa elektroujemność, tym większa atrakcyjność wiązania elektronu. Elektroujemność zmniejsza przejście w dół grupy elementów. Elementy po lewej i lewej stronie układu okresowego wydają się być elektrododatnie lub częściej oddają elektron niż go przyjmują. -
Powinowactwo elektronowe
Powinowactwo elektronowe odzwierciedla to, jak łatwo atom przyjmie elektron. Powinowactwo elektronowe różni się w zależności od grupy elementów. Gazy szlachetne mają powinowactwo elektronowe bliskie zeru, ponieważ wypełniły powłoki elektronowe. Fluorowce mają wysokie powinowactwo elektronowe, ponieważ dodanie elektronu daje atomowi całkowicie wypełnioną powłokę elektronową.
Wiązania chemiczne i wiązania

Wiązania chemiczne są łatwe do zrozumienia, jeśli weźmie się pod uwagę następujące właściwości atomów i elektronów:
- Atomy szukają najbardziej stabilnej konfiguracji.
- Reguła oktetowa stwierdza, że atomy z 8 elektronami na zewnętrznej orbicie będą najbardziej stabilne.
- Atomy mogą dzielić, dawać lub przyjmować elektrony innych atomów. Są to formy wiązań chemicznych.
- Wiązania zachodzą między elektronami walencyjnymi atomów, a nie elektronami wewnętrznymi.
Rodzaje wiązań chemicznych
Dwa główne rodzaje wiązań chemicznych to wiązania jonowe i kowalencyjne, ale należy pamiętać o kilku formach wiązania:
-
Wiązania jonowe
Wiązania jonowe tworzą się, gdy jeden atom pobiera elektron z innego atomu. Przykład: NaCl powstaje przez wiązanie jonowe, w którym sód przekazuje elektron walencyjny chloru. Chlor jest halogenem. Wszystkie halogeny mają 7 elektronów walencyjnych i potrzebują jednego, aby uzyskać stabilny oktet. Sód jest metalem alkalicznym. Wszystkie metale alkaliczne mają 1 elektron walencyjny, który z łatwością przekazują tworząc wiązanie. -
Wiązania kowalencyjne
Wiązania kowalencyjne powstają, gdy atomy dzielą elektrony. Naprawdę główna różnica polega na tym, że elektrony w wiązaniach jonowych są ściślej powiązane z jednym atomem jądro lub drugie, które elektrony w wiązaniu kowalencyjnym mają prawie taką samą szansę na okrążenie jednego jądra, jak inny. Jeśli elektron jest bliżej związany z jednym atomem niż drugi, a polarne wiązanie kowalencyjne może powstać. Przykład: Wiązania kowalencyjne tworzą się między wodorem i tlenem w wodzie, H2O. -
Bond metaliczny
Gdy oba atomy są metalami, powstaje wiązanie metaliczne. Różnica w metalu polega na tym, że elektrony mogą być dowolnym atomem metalu, a nie tylko dwoma atomami w związku. Przykład: Wiązania metaliczne są widoczne w próbkach czystych metali elementarnych, takich jak złoto lub aluminium, lub stopów, takich jak mosiądz lub brąz.
Być może zastanawiasz się, jak rozpoznać, czy wiązanie jest jonowe czy kowalencyjne. Możesz spojrzeć na rozmieszczenie elementów w układzie okresowym lub w tabeli elementów elektroujemności przewidzieć rodzaj wiązania, które powstanie. Jeśli wartości elektroujemności są bardzo różne, powstanie wiązanie jonowe. Zwykle kation jest metalem, a anion jest niemetaliczny. Jeśli oba pierwiastki są metalami, spodziewaj się utworzenia wiązania metalicznego. Jeśli wartości elektroujemności są podobne, spodziewaj się utworzenia wiązania kowalencyjnego. Obligacje między dwoma niemetalami są obligacjami kowalencyjnymi. Polarne wiązania kowalencyjne tworzą się między elementami, które mają pośrednie różnice między wartościami elektroujemności.
Jak nazwać związki - nomenklatura chemiczna
Aby chemicy i inni naukowcy mogli się ze sobą komunikować, system nazewnictwa lub nazewnictwa został uzgodniony przez Międzynarodową Unię Chemii Czystej i Stosowanej lub IUPAC. Usłyszysz chemikalia zwane ich zwyczajowymi nazwami (np. Sól, cukier i soda oczyszczona), ale w laboratorium używasz nazw systematycznych (np. Chlorek sodu, sacharoza i wodorowęglan sodu). Oto przegląd niektórych kluczowych punktów dotyczących nomenklatury.
Nazewnictwo związków binarnych
Związki mogą składać się tylko z dwóch elementów (związków binarnych) lub więcej niż dwóch elementów. Określając związki binarne, obowiązują pewne zasady:
- Jeśli jeden z elementów jest metalem, nazywa się go pierwszy.
- Niektóre metale mogą tworzyć więcej niż jeden jon dodatni. Powszechnie określa się ładunek jonu za pomocą cyfr rzymskich. Na przykład FeCl2 oznacza chlorek żelaza (II).
- Jeśli drugim elementem jest niemetal, nazwą związku jest nazwa metalu, po której następuje rdzeń (skrót) nazwy niemetalicznej, po której następuje „ide”. Na przykład NaCl nosi nazwę chlorku sodu.
- W przypadku związków składających się z dwóch niemetali pierwszy element jest bardziej elektrododatni. Trzon drugiego elementu nosi nazwę, a po nim „ide”. Przykładem jest HCl, który jest chlorowodorem.
Nazywanie związków jonowych
Oprócz zasad nazewnictwa związków binarnych istnieją dodatkowe konwencje nazewnictwa związków jonowych:
- Niektóre aniony wieloatomowe zawierają tlen. Jeśli pierwiastek tworzy dwa oksyaniony, ten z mniejszą ilością tlenu kończy się na-in, podczas gdy ten z większą liczbą oksyenów kończy się na inate. Na przykład:
NIE2- jest azotynem
NIE3- jest azotanem